設備確認與風險評估 確保質量與安全的關鍵步驟
在制藥、醫療器械、食品加工及許多工業領域,設備確認與風險評估是確保產品質量、工藝穩定性和操作安全性的基石。這兩個相輔相成的過程,共同構成了一個主動的、系統化的管理體系,旨在預防缺陷、降低風險,并最終保障最終用戶和環境的福祉。
一、設備確認:構建可靠性的框架
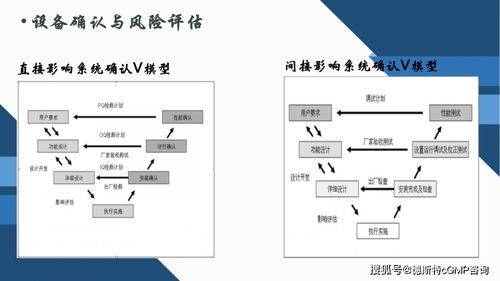
設備確認并非一次性事件,而是一個貫穿設備生命周期的持續過程。它通過客觀證據證明,設備能夠持續、穩定地按照預定用途和要求運行。國際通行的確認活動通常遵循經典的“V”模型,分為四個核心階段:
- 設計確認:這是確認過程的起點。在設備采購或設計之初,就需要通過文件化方式(如用戶需求說明)明確設備的用途、功能、性能指標以及必須符合的法規和標準(如GMP、GAMP 5)。其核心是確保“設計出來的設備”能夠滿足用戶和法規的需求。
- 安裝確認:設備到位后,IQ階段旨在驗證設備是否正確安裝,其組件、配套設施(如電力、氣體、軟件版本)是否符合設計規格和制造商的要求。這包括核對設備清單、檢查安裝環境(如潔凈度、溫濕度)以及完成必要的校準。
- 運行確認:在靜態檢查之后,OQ通過一系列測試,驗證設備在空載或模擬負載狀態下,其各項功能(如轉速、溫度控制、報警系統)能否在整個操作范圍內正常運行。它回答的問題是:“設備能按設計的方式工作嗎?”
- 性能確認:這是最終的、也是最關鍵的驗證環節。PQ在設備的實際使用條件下,使用真實的生產物料或模擬介質,證明設備能夠持續、穩定地生產出符合預定質量標準的產品。它證明的是:“設備在‘真實世界’中能持續產出好產品。”
二、風險評估:識別與管控的導航儀
風險評估是一個系統化的過程,用于識別、分析和評價與設備相關的潛在危害,并據此確定控制措施。其目的不是消除所有風險(這通常不現實),而是將風險降低到可接受的水平。一個有效的風險評估通常遵循以下步驟:
- 風險識別:基于設備特性、工藝知識和歷史數據,系統地找出所有可能出錯的地方。常用工具包括:頭腦風暴、失效模式與效應分析(FMEA)、危害與可操作性分析(HAZOP)等。問題可能涉及設備故障、操作失誤、清潔死角、數據完整性漏洞等。
- 風險分析:對識別出的每個風險,評估其發生的可能性(概率)和一旦發生所造成后果的嚴重性(影響)。這可以是定性(高、中、低)或半定量(打分)的分析。
- 風險評價:將分析結果與預先設定的風險可接受標準進行比較,以確定哪些風險是可接受的,哪些是不可接受的,需要優先處理。
- 風險控制:針對不可接受的風險,制定并實施控制措施。這遵循“ALARP”(合理可行最低)原則,措施可以包括:重新設計設備(消除)、增加安全聯鎖或報警(工程控制)、修訂操作規程(行政控制)、或提供個人防護裝備(PPE)。
- 風險回顧:風險評估不是一勞永逸的。當設備發生重大變更、出現新的故障模式或法規更新時,必須重新進行風險評估,確保其持續有效。
三、二者的協同與整合:事半功倍的質量保證
設備確認與風險評估并非兩條平行線,而是深度融合的有機整體:
- 以風險為導向的確認:現代質量管理理念(如ICH Q9)強調基于風險的決策。這意味著,確認活動的深度和廣度應與風險評估的結果相匹配。對于高風險區域(如直接影響產品質量的關鍵工藝設備),需要進行全面、嚴格的確認;對于低風險區域(如輔助設備),則可以簡化確認流程,從而優化資源分配。
- 確認活動為風險評估提供輸入:在DQ階段識別的設計缺陷,或在OQ/PQ中發現的性能偏差,本身就是重要的風險來源,應納入風險評估的范疇。
- 風險評估為確認活動劃定重點:風險評估的輸出,直接決定了在IQ、OQ、PQ中需要特別關注和測試的關鍵方面,使確認工作更具針對性和效率。
結論
設備確認與風險評估是質量管理體系中不可分割的核心組成部分。通過嚴謹的設備確認,我們為可靠的工藝奠定了物理基礎;通過系統的風險評估,我們為潛在的問題安裝了預警和防護系統。將兩者有機結合,實施一種“基于風險的確認”策略,不僅能確保符合日益嚴格的法規要求(如FDA 21 CFR Part 11, EU GMP Annex 11),更能從源頭提升產品質量、保障生產安全、降低運營成本,最終贏得市場和患者的信任。這是一項必須持續投入、持續改進的戰略性投資。
如若轉載,請注明出處:http://www.yxdfg.com/product/655.html
更新時間:2025-12-30 15:50:25